
Тип амидной связи, которая возникает в процессе образования белков пептидов после взаимодействий двух аминокислот, это и является ответом на вопрос, что такое пептидная связь.
Из пары аминокислот появляется дипептид, то есть цепь из этих аминокислот, плюс молекула воды. По такой же системе происходит генерация цепочек подлиннее из аминокислот у рибосом, то есть полипептидов и белков.
Свойства цепочки
Различные аминокислоты, являющиеся своего рода «строительным материалом» для белка, имеют радикал R.
Как и с любыми амидами, пептидная связь белка цепи C-N с помощью взаимодействия канонических структур между карбонильным углеродом и азотным атомом, как правило имеет свойство двойной. Обычно это находит проявление в снижении ее длины до 1,33 ангстрема.
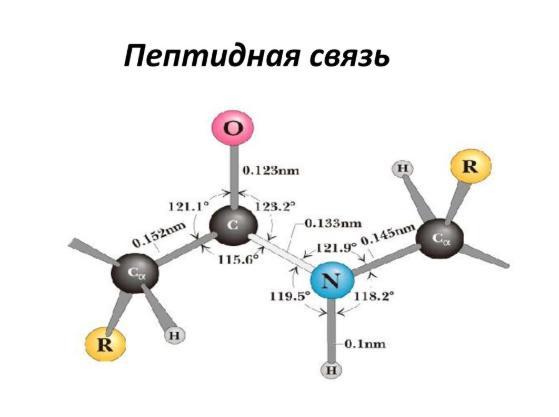
Все это ведет к следующим выводам:
- C, H, O и N — 4 связных атома, плюс 2 a-углерода располагаются на одной плоскости. Группы R аминокислот и a-углеродные водороды располагаются уже за пределами этой зоны.
- Н и О в пептидной связи аминокислот и a-углероды пары аминокислот являются транс-ориентированными, хотя транс-изомер более стабилен. У L-аминокислот R-группы тоже являются транс-ориентированными, что присутствует во всех пептидах и белках в природе.
- Вращение вокруг цепочки C-N сложно, более вероятно вращение у связи C-C.
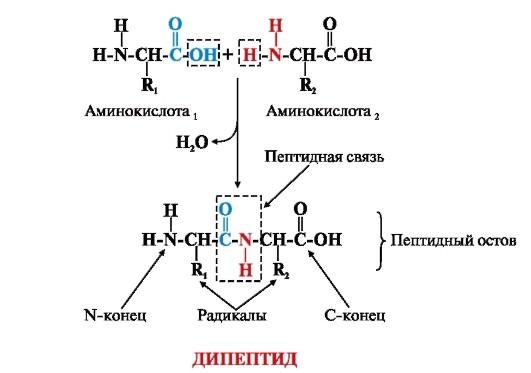
Для того чтобы понять, что такое пептидная связь, а также для обнаружения самих пептидов с белками и определения их количества в определенном растворе, пользуются биуретовой реакцией.
Расположения атомов
Соединение в пептидах белков короче, чем в других пептидных группах, так как она обладает частичной характеристикой связи двойной. Учитывая, что такое пептидная связь, можно сделать вывод о малой ее подвижности.
Электронное построение пептидной связи задает твердую плоскую структуру группы пептидов. Плоскости таких групп располагаются друг к другу под углом. Связь между атомом a-углерода и группами a-карбоксильной и a-аминогруппой может проворачиваться по своей оси свободно, при том, что ограничена в размере и характером радикалов, а это дает возможность для полипептидной цепочки задавать себе различные настройки.
Пептидные связи в белках, как правило, находятся в транс-конфигурации, то есть расположение атомов a-углерода размещается в разных частях группы. Результатом является расположение боковых радикалов у аминокислот на более отдаленном расстоянии в пространстве друг от друга.
Разрыв белков
Изучая, что такое пептидная связь, обычно учитывают ее прочность. Такие цепочки не разрываются сами по себе при нормальных условиях внутри клетки. То есть при подходящей температуре тела и нейтральной среде.
В условиях лаборатории гидролиз белковых пептидных цепочек изучают в запаянных ампулах, внутри которых находится концентрированная соляная кислота, при температуре свыше ста пяти градусов по Цельсию. Полностью белковый гидролиз до состояния свободных аминокислот происходит примерно за 24 часа.
К вопросу от том, что такое пептидная связь внутри живых организмов, то в них разрыв происходит при участии определенных ферментов-протеолитов. Дабы отыскать в растворе пептиды и белки, а также узнать их количество, пользуются положительным результатом веществ, которые содержат в себе две или более пептидные связи, то есть биуретовую реакцию.
Замена аминокислоты
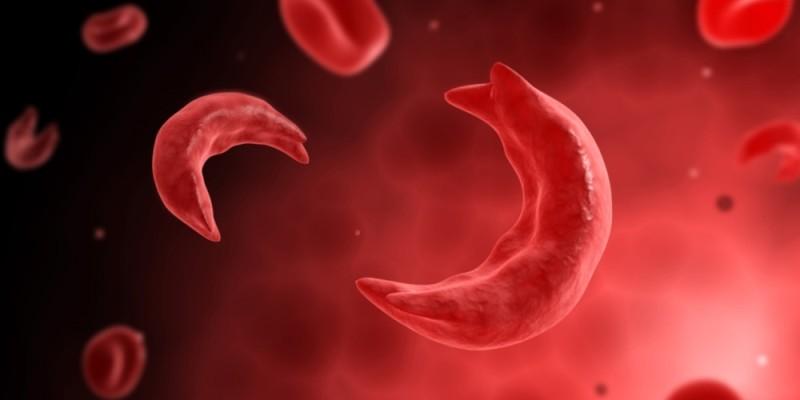
Внутри аномального гемоглобина S мутировали 2 β-цепи, глутамат в которых, а также отрицательно заряженная высокополярная аминокислота в шестом положении, были подменены содержащим радикал гидрофобным валином.
Внутри мутировавшего гемоглобина находится участок, который является комплиментарным другому участку с такими же молекулами, что содержит измененную аминокислоту. В конечном итоге молекулы гемоглобина «слиплись вместе» и образовали длинные фибриллярные агрегаты, которые изменяют эритроцит и ведут к появлению мутирующего эритроцита серповидной формы.
Внутри оксигемоглобина S в результате смены белковой конформации маскируется комплиментарный участок. Отсутствие доступа к нему не дает возможности для соединения молекул друг с другом у этого оксигемоглобина. Существуют условия, способствующие образованию HbS агрегатов. Они увеличивают скопления дезоксигемоглобина внутри клеток. К ним могут относиться:
- гипоксия;
- высокогорные условия;
- физический труд;
- полет на самолете.
Серповидно-клеточная анемия
Поскольку эритроциты в виде «серпов» имеют низкую проходимость сквозь капилляры тканей, они могут перекрыть собой сосуды и, таким образом, создать местную гипоксию. Это увеличит скопление дезоксигемоглобина S внутри эритроцитов, а также скорость, с которой появляются агрегаты S-гемоглобина и создают еще большие условия для эритроцитной деформации.

Серповидно-клеточная анемия — это рецессивное заболевание гомозигот, которое возникает только в ситуации, когда оба родителя передают пару мутирующих генов β-цепей. После того как ребенок родится, заболевание не проявит себя ровно до той поры, пока большие количества HbF не поменяются на HbS. У больных обнаруживается клиническая симптоматика, которая характерна для анемии, то есть: боли головы и головокружения, частое сердцебиение, одышка, слабость к инфекциям и так далее.




















